Цик при ревматоидном артрите
Цик при ревматоидном артрите

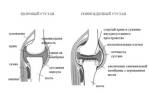
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р 0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
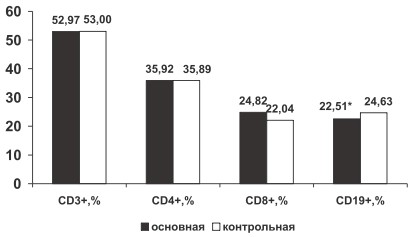
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р 0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р 0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
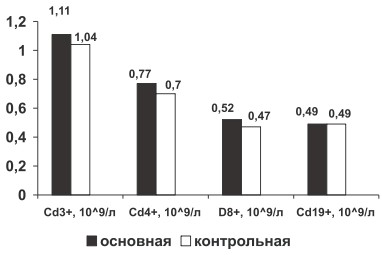
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Диагностика ревматоидного артрита на ранних стадиях заболевания
М. В. ГОЛОВИЗНИН, доцент кафедры внутренних болезней стоматологического факультета Московского государственного медико-стоматологического университета
Перспективы связаны с иммуноактивной терапией
Ревматоидный артрит (РА) является наиболее распространенным заболеванием соединительной ткани. Оно неуклонно прогрессирует, рано приводит к утрате трудоспособности и снижает продолжительность и качество жизни пациентов. В первые 3 года болезни трудоспособность утрачивают 37,5% больных, а через 5 лет более чем 50% больных РА уже не способны продолжать работу.
Возможности улучшения прогноза при РА связаны с применением адекватной иммуноактивной терапии до начала развития деструктивного процесса в суставах. Минимальная продолжительность этого периода времени составляет около 3 месяцев с момента дебюта болезни. Однако на практике почти в половине случаев диагноз РА ставится больным лишь тогда, когда у них выявляются рентгенологические признаки достоверных, а следовательно, уже необратимых, суставных деструкций. Причин несвоевременной постановки диагноза РА на этапе первой врачебной помощи несколько.
Главной является недостаточное знаком-ство докторов общей практики с дифференциальным диагнозом заболеваний суставов. РА и другие ревматические болезни схожи на начальных этапах развития. Современная медицина пока не располагает абсолютным критерием, позволяющим на 100% отличать РА от другой суставной патологии. В связи с этим диагноз РА ставится по совокупности признаков, каждый из которых имеет различную степень достоверности. Для диагностики РА повсеместно применяют предложенные в 1987 году Американской коллегией ревматологов (AКР) классификационные критерии (табл.). Критерии 1—4 должны наблюдаться не менее 6 недель. Диагноз РА устанавливается при наличии не менее 4 критериев. Чувствительность критериев — 91,2%, специфичность — 89,3%. В развернутой стадии болезни эти критерии действительно имеют высокую чувствительность и специфичность (около 90%).
Ранняя диагностика крайне важна
Однако при раннем РА эффективность диагностики гораздо ниже. Например, подкожные ревматоидные узелки редко выявляются на первом году заболевания. Рентгенологические изменения в ранние сроки РА неспецифичны или могут отсутствовать. То же относится и к присутствию у пациентов в крови ревматоидного фактора. Тогда основное значение в постановке диагноза имеет симметричный артрит с вовлечением кисти и запястья, сопровождающийся продолжительной утренней скованностью.
Относительно последнего признака мы хотели бы заострить внимание читателя. Скованность — тугоподвижность суставов, связанная со снижением уровня эндогенных кортикостероидов в утренние часы, а не боль является достоверным диагностическим критерием РА.
По данным зарубежных исследователей, одной из главных причин отсроченной постановки диагноза РА является позднее направление больного к ревматологу. Для уменьшения потери времени на этапе первичного контакта с врачом общей практики и своевременного направления пациента к ревматологу Emery P. и соавт. (2002 г.) предложили критерии «впервые выявленного» РА (см. табл.).
Эти признаки не являются основанием для достоверного диагноза, однако достаточно хотя бы одного из этих критериев, чтобы направить пациента к ревматологу, который должен провести анализ характера и длительности суставного синдрома, выявить возможные внесуставные проявления РА, провести лабораторные и инструментальные исследования. Следует также иметь в виду, что ранний РА характеризуется наличием «доклинического периода» у 71%, частым началом с моноолигоартритом (70%), «масками» остеоартроза (26,2%), реактивного артрита (23,8%), подагры (4,6).
Следующий этап — признаки воспаления
Лабораторные признаки РА — следующий этап алгоритма, это, конечно, признаки воспаления. Однако оценка СОЭ, С-реактивного белка (СРБ), белковых фракций имеет второстепенное значение в диагностическом процессе на ранних этапах. И отсутствие их изменений не должно препятствовать постановке диагноза. В первые 2—3 месяца величины этих параметров не менее чем у 50% больных не выходят за пределы нормы. Кроме того, изменения острофазовых показателей типичны и для других заболеваний суставов.
Тем не менее дебют РА у лиц пожилого возраста (старше 55 лет) сопровождается выраженной клинико-лабораторной активностью болезни — высоким уровнем СОЭ, СРБ, альфа 2 и гамма-глобулинов. В клиническом течении преобладает острое начало с лихорадочным синдромом без четкого продромального периода, стойкий полиартрит, нередко торпидный к терапии. Вышесказанное важно и потому, что эти проявления манифестируют на фоне уже имеющихся других суставных заболеваний, в первую очередь, остеоартроза, что также затрудняет верификацию РА, традиционно считающегося «болезнью молодого возраста». Именно высокие, нетипичные для остеоартроза, показатели СОЭ и уровня острофазовых белков должны навести врача на мысль о дебюте РА у пожилого больного.
Большее значение имеет обнаружение в крови ревматоидного фактора (РФ) в диагностических титрах. Однако примерно у 20% больных РА РФ в сыворотке крови отсутствует. Кроме того, РФ обнаруживают примерно у 5% здоровых людей, у 5—25% лиц пожилого возраста, а также у значительного числа больных с хроническими заболеваниями (системной красной волчанкой, системной склеродермией и др.).
Иммунологический тест улучшил диагностику
Указанных ограничений лишен недавно внедренный в клиническую практику новый иммунологический тест — определение антител к циклическому цитруллинированному пептиду (анти-ЦЦП-АТ), что повысило эффективность лабораторной диагностики РА на ранних стадиях. У больных с РА было выявлено несколько аутоантител, направленных против белков, содержащих цитруллин. Первым таким аутоантителом был антиперинуклеарный фактор. Специфичность анти-ЦЦП-АТ при диагностике РА на ранних стадиях составляет 86%, комбинации анти-ЦЦП-АТ + СОЭ — 95%, анти-ЦЦП-АТ + РФ — 91%, анти-ЦЦП-АТ + СРБ — 97%, анти-ЦЦП-АТ + полиартрикулярная боль — 95%, анти-ЦЦП-АТ + утренняя скованность — 99%. Особенно диагностически значимо определение анти-ЦЦП-АТ у лиц с низкими титрами ревматоидного фактора.
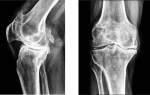
Рентгенография суставов — достоверный, но на ранних стадиях заболевания имеющий низкую диагностическую ценность, метод исследования. Околосуставной остеопороз как признак первой рентгенологической стадии РА развивается как минимум в течение нескольких недель. А костные эрозии и узуры — наиболее важный симптом РА — являются поздним признаком и могут обнаруживаться лишь спустя много месяцев. Тем не менее рентгенография суставов обязательна при любом подозрении на РА.
В первую очередь выполняется снимок кистей вне зависимости от степени субъективных и объективных признаков их поражения. Эрозии и сужение суставной щели проксимальных межфаланговых суставов обеих кистей рук наиболее типичны для РА. Они могут прогрессировать субклинически и, следовательно, их обнаружение дополняет картину даже при нерезко выраженных признаках воспаления. Рентгенологические изменения в крупных суставах считаются менее специфичными для РА. Тем не менее, особенно при серонегативных формах болезни, исследование костей таза может быть диагностически значимым.
На ранних стадиях РА наиболее чувствительным методом для выявления диагностически значимых изменений в суставах является МРТ. Этот метод позволяет обнаружить изменения в мягких тканях. Более доступным для клинической практики является метод допплеровского ультразвукового исследования суставов, который, как и МРТ, обладает большей, по сравнению с рентгенографией, чувствительностью в выявлении характерных для РА изменений в суставах. В первые месяцы заболевания, помимо визуализации синовита и тендовагинита, большое значение для постановки диагноза имеет обнаружение паннуса, который выглядит как гроздевидное утолщение синовиальной оболочки до 4—6 мм с усиленной васкуляризацией. На поздних стадиях толщина паннуса может достигать 10—12 мм, при этом выраженность его васкуляризации значительно варьирует. Этот метод имеет преимущества при исследовании плечевых и тазобедренных суставов, хуже доступных для физикального обследования. При других распространенных заболеваниях суставов (реактивных артритах, остеоартрозе) паннус не образуется. Напротив, в суставах характерен синдром «минус ткань», когда визуализация фиксирует разрушение хряща, расширение суставной щели и дефекты костной ткани без наличия пролиферирующей синовии.
Итак, дебют РА возможен как в молодом, так и в пожилом возрасте. В последнем случае болезнь имеет более агрессивный и прогностически менее благоприятный характер. Как мы показали выше, «классические» критерии диагностики РА на ранних стадиях имеют существенные дополнения. Оценка уровня антицитруллиновых антител, подключение ультразвукового и МРТ-исследования суставов расширяют возможности ранней диагностики этого тяжелого и социально значимого заболевания.
Диагностика ревматоидного артрита на ранних стадиях представляет самостоятельную клиническую проблему, которая является ключевой для своевременного назначения препаратов, предотвращающих прогрессирование болезни.
Перспективы улучшения прогноза при ревматоидном артрите связаны с применением адекватной иммуноактивной терапии до начала развития деструктивного процесса в суставах.
Лечение ревматоидного артрита: базисная терапия, симптоматическая и реабилитация
Ревматоидный артрит – это аутоиммунная патология, при которой разрушаются мелкие и крупные суставы. Болезнь обычно возникает после 30 лет, причем у женщин она встречается в 6 раз чаще, чем у мужчин.
При заболевании ревматоидный артрит – лечение нужно начинать при появлении первых симптомов (наиболее полный обзор методов терапии читайте по ссылке: http://sustavzdorov.ru/artrit/revmatoidnyj-lechenie-212.html). Своевременная терапия способна предупредить прогрессирование болезни, необратимую деформацию суставов, снижение трудоспособности и инвалидность.
Лечение при ревматоидном артрите длительное (от полугода до 2-х лет) и включает в себя комбинацию нескольких лекарственных препаратов, физиотерапию и диетическое питание.
Рассмотрим методы эффективного лечения болезни подробнее.

Лекарственные препараты
Для терапии ревматоидного артрита применяют несколько групп лекарственных препаратов. Одни из них воздействуют на причину болезни (базисные средства), другие – устраняют только симптомы заболевания (симптоматические средства).
Базисная терапия
Базисные (иммуносупрессивные) лекарственные средства направлены на устранение причины заболевания: они предотвращают аутоиммунное воспаление соединительной ткани суставов и других органов, что приводит к стойкой ремиссии и улучшению общего состояния. Базисные средства улучшают прогноз в лечении недуга, если их назначают в первые месяцы после начала заболевания, а также они способны предупредить разрушение суставов и инвалидность.
Базисная терапия включает в себя препараты первого и второго ряда:
- Лекарственные средства первого ряда обладают высокой эффективностью. Это препараты: метотрексат, арава (лефлуномид), сульфасалазин.
- Медикаменты второго ряда оказывают более слабое действие, их назначают при индивидуальной непереносимости лекарств первого ряда. Примеры препаратов: кризанол, тауредон, делагил, плаквенил, азатиоприн, циклофосфан.
Для получения стойких результатов при быстром разрушении суставов и поражении внутренних органов применяют схемы терапии с использованием двух базисных средств.
Базисные средства принимают в течение 6–18 месяцев, по показаниям – на более длительный период. Клинический эффект возникает после 1,5–2 месяцев приема препаратов.
Биологические препараты
Инновационная разработка в базисной терапии – биологические препараты, которые эффективно устраняют аутоиммунное воспаление в течение недели после применения. Они значительно подавляют иммунитет, эти медикаменты назначают при низкой эффективности и плохой переносимости препаратов первого ряда.
Биологические лекарственные средства:
- инфликсимаб (ремикейд),
- ритуксимаб,
- абатацепт,
- анакинра.

Симптоматические препараты
Для устранения симптомов заболевания назначают нестероидные противовоспалительные препараты (НПВП) и глюкокортикоиды.
НПВП эффективно снимают болевой синдром, скованность движений и снижают температуру тела, что улучшает подвижность суставов и общее самочувствие. Противовоспалительный эффект лекарственных средств основан на блокаде синтеза простагландинов – биологически активных веществ, которые провоцируют воспаление в суставах. Препараты назначают при обострении болезни сроком на 2–8 недель.
- диклофенак,
- целекоксиб,
- мовалис,
- лорноксикам,
- нимесулид,
- аркоксиа,
- ибупрофен.
Глюкокортикоиды
Глюкокортикоиды применяют при неэффективности НПВП в случае интенсивных болей и сильном воспалении. Также гормональные препараты показаны при стойком синовите – скоплении экссудата в полости сустава.
- преднизолон (медопред),
- дексаметазон,
- триамцинолон (кеналог),
- бетаметазон (целестон).
Дозировку глюкокортикоидов постепенно повышают при назначении и уменьшают при отмене препарата для предупреждения побочных эффектов (нарушения функции надпочечников, гипертонии, сахарного диабета). Лечение обычно продолжают 4–6 недель.

Другие методы терапии
Плазмаферез
Чтобы очистить кровь от циркулирующих проблемных иммунных комплексов (особых комплексов антител), проводят плазмаферез, который уменьшает воспаление в тканях.
Лазерная терапия и криотерапия (лечение низкими температурами) позволяют снизить активность аутоиммунного поражения суставов.
Эти методы используют в качестве дополнительного лечения на фоне приема медикаментов. На курс терапии назначают 4–8 процедур.
Диета
Большое значение имеет диета, позволяющая укрепить суставы и снизить воспаление в соединительной ткани. Из рациона питания исключают острую и жирную пищу, ограничивают употребление цитрусовых, молочных продуктов, кукурузы, пшеницы. В меню включают рыбу, морепродукты, свежие овощи и фрукты, растительное масло, гречневую и перловую крупу. Прием пищи должен быть не реже 5 раз в сутки.
Физиотерапия
После затихания острого процесса назначают физические методы лечения. Для улучшения кровотока и метаболизма суставов применяют физиопроцедуры: амплипульстерапию и озокеритотерапию, фонофорез с гидрокортизоном.
Массаж улучшает тонус мышц и питание пораженных тканей.
Регулярные занятия лечебной физкультурой восстанавливают подвижность в суставах.